Учебная работа № 1193. Влияние вращательного и поступательного движения молекул на теплоёмкость многоатомных газов
Вступление
Прежде чем приступить к подробному вычислению термодинамических величин газов с учетом различных квантовых эффектов, полезно рассмотреть эту же задачу с точки зрения чисто классической статистики. В дальнейшем мы увидим, в каких случаях и в какой мере получающиеся при этом результаты могут быть применены к реальным газам.
Молекула представляет собой конфигурацию атомов, совершающих малые колебания около определенных положении равновесия, соответствующих минимуму потенциальной энергии их взаимодействия. Последняя имеет при этом вид
![]() ,
,
где e0 — потенциальная энергия взаимодействия атомов, когда все они находятся в положениях равновесия; второй же член есть квадратичная функция координат, определяющих отклонения атомов от положений равновесия. Число rкол координат в этой функции есть число колебательных степеней свободы молекулы. Последнее можно определить по числу п атомов в молекуле. Именно, nатомная молекула имеет всего 3п степеней свободы. Из них три соответствуют поступательному движению молекулы как целого и три — ее вращению как целого. Если все атомы расположены по одной прямой (в .частности, у двухатомной молекулы), то вращательных степеней свободы всего две. Таким образом, нелинейная nатомная молекула имеет всего 3п 6 колебательных степеней свободы, а линейная 3п 5. При п = 1 колебательных степеней свободы, конечно, совсем нет, так как все три степени свободы атома соответствуют поступательному движению.
Полная энергия e молекулы есть сумма потенциальной и кинетической энергий. Последняя является квадратичной функцией от всех импульсов, число которых равно полному числу 3п степеней свободы молекулы. Поэтому энергия e имеет вид
![]() ,
,
где f11 (p,q) — квадратичная функция импульсов и координат; полное число переменных в этой функции есть l = 6n—6 (для нелинейной молекулы) или l = 6n—5 (для линейной); у одноатомного газа l = 3, так как координаты вообще не входят в выражение для энергии.
Подставляя это выражение для энергии в формулу
![]()
где интегрирование производится по фазовому пространству молекулы, а ![]() ,
,
имеем
![]() .
.
Для того чтобы определить температурную зависимость входящего сюда интеграла, произведем подстановку ![]()
![]() для всех l переменных, от которых зависит функция f11 (р, q). Вследствие квадратичности этой функции будет:
для всех l переменных, от которых зависит функция f11 (р, q). Вследствие квадратичности этой функции будет:
![]() ,
,
и T в показателе подынтегрального выражения сократится. Преобразование же дифференциалов этих переменных, входящих в dt, даст множитель Tl /2 , который выносится за знак интеграла. Интегрирование по колебательным координатам q производится по той области их значений, которая соответствует колебаниям атомов внутри молекулы. Поскольку, однако, подынтегральная функция быстро уменьшается с увеличением q, то интегрирование можно распространить на всю область от ¥ до +¥, как и для всех импульсов. Сделанная нами замена переменных не изменит тогда пределов интегрирования, и весь интеграл будет некоторой не зависящей от температуры постоянной. Учитывая также, что интегрирование по координатам центра инерции молекулы дает занимаемый газом объем V, получим в результате для свободной энергии выражение вида
![]() , (1.1)
, (1.1)
где (А — постоянная).
Мы увидим в дальнейшем, что в целом ряде важных случаев теплоемкость газа оказывается – в более или менее значительных интервалах температуры – величиной постоянной, не зависящих от температуры. Имея в виду это обстоятельство, мы вычисляем здесь в общем виде термодинамические величины такого газа.
Дифференцируя выражение
![]()
для энергии, найдем, что функция f(T) связана с теплоемкостью сu посредством – Тf’’(T)=cu . Интегрируя это соотношение, получим:
![]()
где z и e0 – постоянные. Подставляя это выражение в
![]()
получим для свободной энергии следующее окончательное выражение:
![]() (1.2)
(1.2)
где z химическая постоянная газа.
Раскрывая логарифм в выражении (1.1), мы получим в точности выражение типа (1.2) с постоянной теплоемкостью, равной
![]() (1.3)
(1.3)
Таким образом, чисто классический идеальный газ должен обладать постоянной теплоемкостью. Формула (1.3) позволяет при этом высказать следующее правило: на каждую переменную в энергии e(р, q) молекулы приходится по равной доле 1/2 в теплоемкости cv газа (k/2 в обычных единицах), или, что то же, по равной доле Т/2 в его энергии. Это правило называют законом равнораспределения.
Имея в виду, что от поступательных и вращательных степеней свободы в энергию e(р, q) входят только соответствующие им импульсы, мы можем сказать, что каждая из этих степеней свободы вносит в теплоемкость вклад, равный 1/2. От каждой же колебательной степени свободы в энергию e(р, q) входит по две переменных (координата и импульс), и ее вклад в теплоемкость равен 1.
Вращательная теплоемкость многоатомных газов.
Свободную энергию многоатомного газа, как и двухатомного, можно представить в виде суммы трех частей — поступательной, вращательной и колебательной. Поступательная часть характеризуется теплоемкостью и химической постоянной, равными:
![]()
![]()
![]()
Благодаря большой величине моментов инерции многоатомных молекул (и соответственно малости их вращательных квантов) их вращение можно всегда рассматривать классически[1] . Многоатомная молекула обладает тремя вращательными степенями свободы и тремя в общем случае различными главными моментами инерции I1 , I2 , I3 ; поэтому ее кинетическая энергия вращения есть
![]()
где, — координаты вращающейся системы, оси которой совпадают с главными осями инерции молекулы, (оставляем пока в стороне особый случай молекул, составленных из атомов, расположенных на одной прямой). Это выражение должно быть подставлено в статистический интеграл
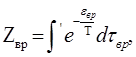 (2.1)
(2.1)
где
![]()
а штрих у интеграла означает, что интегрирование должно производиться лишь по тем ориентациям молекулы, которые физически отличны друг от друга.
Если молекула обладает какимилибо осями симметрии, то повороты вокруг этих осей совмещают молекулу саму с собой и сводятся к перестановке одинаковых атомов. Ясно, что число физически неразличимых ориентации молекулы равно числу допускаемых ею различных поворотов вокруг осей симметрии (включая тождественное преобразование—поворот на 360°). Обозначив это число посредством [2] , можно производить интегрирование в (2.1) просто по всем ориентациям, одновременно разделив все выражение на В произведении dx dh dz трех бесконечно малых углов поворота) можно рассматривать dx , dh как элемент dsz телесного угла для направлений оси z.
Интегрирование по dsz производится независимо от интегрирования по поворотам dz вокруг самой оси z и дает 4p. После этого интегрирование по djz дает еще 2p.
Интегрируя также и по dMx dMh dMz (в пределах от ¥ до +¥), найдем в результате


Таким образом, для вращательной теплоемкости имеем в соответствии с (1.3)
![]()
а химическая постоянная

Если все атомы в молекуле расположены на одной прямой (линейная молекула), то она обладает, как и двухатомная молекула, всего двумя вращательными степенями свободы и одним моментом инерции /. Вращательные теплоемкость и химическая постоянная равны, как и у двухатомного газа,
![]()
![]()
где s=1 для несимметричной молекулы (например, NNO) и s=2 для молекулы, симметричной относительно своей середины (например, ОСО).
Колебательная часть термодинамических величин газа становится существенной при значительно более высоких температурах, чем вращательная, потому что интервалы колебательной структуры термов велики по сравнению с интервалами вращательной структуры.
Мы будем считать, однако, температуру большой лишь настолько, чтобы были возбуждены в основном не слишком высокие колебательные уровни. Тогда колебания являются малыми (а потому и гармоническими), и уровни энергии определяются обычным выражением ħw(u + 1 /2 ).
Число колебательных степеней свободы определяет число так называемых нормальных колебаний молекулы, каждому из которых соответствует своя частота wa (индекс a нумерует нормальные колебания). Надо иметь в виду, что некоторые из частот wa могут совпадать друг с другом; в таких случаях говорят о кратной частоте.
Вычисление колебательной статистической суммы Zкол производится элементарно. Вследствие очень быстрой сходимости ряда суммирование можно формально распространить до u=¥. Условимся отсчитывать энергию молекулы от наиболее низкого (u = 0) колебательного уровня, т. е. включаем ħw/2 в постоянную e0 в
![]()
В гармоническом приближении, когда мы считаем колебания малыми все нормальные колебания независимы, и колебательная энергия есть сумма энергий каждого колебания в отдельности. Поэтому колебательная статистическая сумма
![]() ,
,
распадается на произведение статистических сумм отдельных колебаний,

а для свободной энергии FKOJl получается сумма выражений
![]() ,
,
т. е.

В эту сумму каждая частота входит в числе раз, равном ее кратности. Такого же рода суммы получаются соответственно для колебательных частей других термодинамических величин.
Каждое из нормальных колебаний дает в своем классическом предельном случае (T>>ħwa ) вклад в теплоемкость, равный c( a ) кол = 1 при Т, большем наибольшего из ħwa , получилось бы скол = rкол . Фактически, однако, этот предел не достигается, так как многоатомные молекулы обычно распадаются при значительно более низких температурах.
Различные частоты wa многоатомной молекулы разбросаны обычно в очень широком интервале значений. По мере повышения температуры постепенно «включаются» в теплоемкость различные нормальные колебания. Это обстоятельство приводит к тому, что теплоемкость многоатомных газов в довольно широких интервалах температуры часто можно считать примерно постоянной.
Упомянем о возможности своеобразного перехода колебаний во вращение, пример которого представляет молекула этана С2 Н6 . Эта молекула построена из двух групп СН3 , находящихся на определенном расстоянии друг от друга и определенным образом взаимно ориентированных. Одно из нормальных колебаний молекулы представляет собой «крутильное колебание», при котором одна из групп СН3 поворачивается относительно другой. При увеличении энергии колебаний их амплитуда растет и в конце концов, при достаточно высоких температурах, колебания переходят в свободное вращение. В результате вклад этой степени свободы в теплоемкость, достигающий при полном возбуждении колебаний примерно величины 1, при дальнейшем повышении температуры начинает падать, асимптотически приближаясь к характерному для вращения значению 1/2.
Наконец, укажем, что если молекула обладает отличным от нуля спином S (например, молекулы NO2 , C1O2 ), то к химической постоянной добавляется величина
![]()
До сих пор мы рассматривали вращение и колебания как независимые движения молекулы, в действительности же одновременное наличие того и другого приводит к своеобразному взаимодействию между ними (Е, Teller, L. Tisza, G. Placzek, 1932— 1933).
Начнем с рассмотрения линейных многоатомных молекул. Линейная молекула может совершать колебания двух типов — продольные с простыми частотами и поперечные с двукратными частотами. Нас будут интересовать сейчас последние.
Молекула, совершающая поперечные колебания, обладает, вообще говоря, некоторым моментом импульса. Это очевидно уже из простых механических соображений[3] , но может быть показано и квантовомеханическим рассмотрением. Последнее позволяет также определить и возможные значения этого момента в данном колебательном состоянии.
Предположим, что в молекуле возбуждена какаялибо одна двукратная частота wа . Уровень энергии с колебательным квантовым числом va вырожден (va + 1)кратно. Ему соответствует va + 1 волновых функций
![]()
(где va 1 + va 2 = va ) или какиелибо любые их независимые линейные комбинации. Общая (по Qa l и Qa 2 ) старшая степень полинома, на который умножается экспоненциальный множитель, во всех этих функциях одинакова и равна va . Очевидно, что всегда можно выбрать в качестве основных функций линейные комбинации функций ![]() вида
вида
![]()
![]()
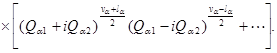
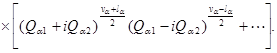
В квадратных скобках стоит определенный полином, из которого мы выписали только старший член. la есть целое число, могущее принимать va + 1 различных значений:
la = va , va — 2, va — 4, …, — va .
Нормальные координаты Qa 1 , Qa 2 поперечного колебания представляют собой два взаимно перпендикулярных смещения от оси молекулы. При повороте вокруг этой оси на угол
j старший член полинома (а с ним и вся функция ![]()
![]()
![]()


Отсюда видно, что функция (3,1) соответствует состоянию с моментом 1a относительно оси.
Таким образом, мы приходим к результату, что в состоянии, в котором возбуждена (с квантовым числом va ) двукратная частота wa , молекула обладает моментом (относительно своей оси), пробегающим значения
![]()
![]()
О нем говорят, как о колебательном моменте молекулы. Если возбуждено одновременно несколько поперечных колебаний, то полный колебательный момент равен сумме åla . Сложенный с электронным орбитальным моментом, он дает полный момент l молекулы относительно ее оси.
Полный момент импульса молекулы J не может быть меньше момента относительно оси, т. е. J пробегает значения
![]()
![]()
Другими словами, состояний с J =0, 1, …. | l | — 1 не существует.
При гармонических колебаниях энергия зависит только от чисел va и не зависит от la . Вырождение колебательных уровней (по значениям la ) снимается при наличии ангармоничности. Снятие, однако, неполное: уровни остаются двукратно вырожденными, причем одинаковой энергией обладают состояния, отличающиеся одновременным изменением знака всех la и l; в следующем (после гармонического) приближении в энергии появляется квадратичный по моментам la член вида
![]()
![]()
(ga b — постоянные). Это остающееся двукратное вырождение снимается эффектом, аналогичным Lудвоению у двухатомных молекул.
Переходя к нелинейным молекулам, необходимо прежде всего сделать следующее замечание чисто механического характера. Для произвольной (нелинейной) системы частиц возникает вопрос о том, каким образом можно вообще отделить колебательное движение от вращения, другими словами, что следует понимать под «невращающейся системой». На первый взгляд, можно было бы подумать, что критерием отсутствия вращения может являться равенство нулю момента импульса:
![]()
![]()
(суммирование по частицам системы). Однако стоящее слева выражение не является полной производной по времени какойлибо функции координат. Поэтому написанное равенство не может быть проинтегрировано по времени так, чтобы быть сформулированным в виде равенства нулю некоторой функции координат. Между тем именно это необходимо для того, чтобы можно было разумным образом сформулировать понятие о «чистых колебаниях» и «чистом вращении».
Поэтому в качестве определения отсутствия вращения надо взять условие
![]()
![]()
где r0 — радиусывекторы положений равновесия частиц. Написав r = r0 + u, где u — смещения при малых колебаниях, имеем v = r = u. Уравнение (3.2) интегрируется по времени, в результате чего получаем
![]()
![]()
Движение молекулы мы будем рассматривать как совокупность чисто колебательного движения, при котором удовлетворяется условие (3.3), и вращения молекулы как целого[4] . Написав момент импульса в виде
![]()
![]()
мы видим, что, в соответствии с определением (3.2) отсутствия вращения, под колебательным моментом надо понимать сумму ![]()
![]()
Молекулы, не обладающие ни одной осью симметрии более чем второго порядка, относятся к типу асимметричного волчка. У молекул этого типа все частоты колебаний — простые (их группы симметрии обладают только одномерными неприводимыми представлениями). Поэтому все колебательные уровни не вырождены. Но во всяком невырожденном состоянии средний момент импульса обращается в нуль. Таким образом, у молекул типа асимметричного волчка средний колебательный момент во всех состояниях отсутствует.
Если в числе элементов симметрии молекулы имеется одна ось более чем второго порядка, молекула относится к типу симметричного волчка. Такая молекула обладает колебаниями как с простыми, так и с двукратными частотами. Средний колебательный момент первых снова обращается в нуль. Двухкратным же частотам, соответствует отличное от нуля среднее значение проекции момента на ось молекулы.
Легко найти выражение для энергии вращательного движения молекулы (типа симметричного волчка) с учетом колебательного момента.
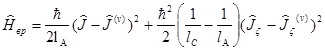
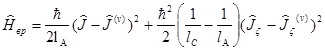
Искомая энергия есть среднее значение Hвр . Члены в (3.5), содержащие квадраты компонент J, дают чисто вращательную энергию. Члены, содержащие квадраты компонент J( v ) , дают не зависящие от вращательных квантовых чисел, постоянные; их можно опустить. Члены же, содержащие произведения компонент J и J(0) , представляют собой интересующий нас здесь эффект взаимодействия колебаний молекулы с ее вращением; его называют кориолисовым взаимодействием (имея в виду его соответствие кориолисовым силам в классической механике).
При усреднении этих членов надо иметь в виду, что средние значения поперечных (x, h) компонент колебательного момента равны нулю. Поэтому для среднего значения энергии кориолисового взаимодействия получаем:
![]()
![]()
где k (целое число) есть, проекция полного момента на ось молекулы, a![]()
![]()
Наконец, рассмотрим молекулы типа шарового волчка. Сюда относятся молекулы с симметрией какойлибо из кубических групп. Такие молекулы обладают одно, дву и трехкратными частотами. Вырождение колебательных уровней, как всегда, частично снимается ангармоничностью; после учета этих эффектов остаются, помимо невырожденных, лишь дву и трехкратно вырожденные уровни. Мы будем сейчас говорить именно об этих расщепленных ангармоничностью уровнях.
Легко видеть, что у молекул типа шарового волчка средний колебательный момент отсутствует не только в невырожденных, но и в двукратно вырожденных колебательных состояниях. Это следует уже из простых соображений, основанных на свойствах симметрии. Действительно, векторы средних моментов в двух состояниях, относящихся к одному вырожденному уровню энергии, должны были бы преобразовываться друг в друга при всех преобразованиях симметрии молекулы. Но ни одна из кубических групп симметрии не допускает существования двух преобразующихся лишь друг в друга направлений; преобразуются друг в друга лишь совокупности не менее чем трех направлений.
Из этих же соображений следует, что в состояниях, соответствующих трехкратно вырожденным колебательным уровням, средний колебательный момент отличен от нуля. После усреднения по колебательному состоянию этот момент представится оператором, изображающимся матрицей, элементы которой соответствуют переходам между тремя взаимно вырожденными состояниями. В соответствии с числом таких состояний этот оператор должен иметь вид ![]()
![]()
![]()
![]()
![]()
![]()
после такого усреднения превращается в оператор
![]()
![]()
Собственные значения первого члена — это обычная вращательная энергия
![]()
![]()
а второй член дает несущественную постоянную, не зависящую от вращательного квантового числа. Последний же член в (3.6) дает искомую энергию кориолисова расщепления колебательного уровня. Собственные значения величины Л вычисляются обычным образом; она может иметь (при заданном J) три различных значения (соответствующих значениям вектора I + J, равным J + 1, J — 1, J). В результате найдем
![]()
![]()
![]()
![]()
![]()
![]()
Список литературы
Ландау Л.Д., Лифшиц Е.М. Теоретическая физика: Учеб. Пособие для вузов. В10 т. Т III. Квантовая механика (нерелятивистская теория) – М.: Наука, 1989 г.
Ландау Л.Д., Лифшиц Е.М. Теоретическая физика: Учеб. Пособие для вузов. В10 т. Т V. Статистическая физика 1ая ч. – М., 1976 г.
Кубо Р., Статистическая механика. М.:, 1967 г.
Сивухин Д.В. Общий курс физики, т.2, Термодинамика и молекулярная физика. ФИЗМАТЛИТ, 2003 г.
[1] Эффекты квантования вращения могли бы наблюдаться лишь у метана СН4 , где они должны появиться при температурах около 50° К.
[2] Так, у Н2 О (равнобедренный треугольник) s=2; у NН3 (треугольная правильная пирамида) s=3; у СН4 (тетраэдр) s=12; у C6 H6 (правильный шестиугольник) s=12.
[3] Так, два взаимно перпендикулярных поперечных колебания с разностью фаз в я/2 можно рассматривать как чистое вращение изогнутой молекулы вокруг
[4] Поступательное движение предполагается отделенным с самого начала выбором системы координат, в которой центр инерции молекулы покоится.

 (3 оценок, среднее: 4,67 из 5)
(3 оценок, среднее: 4,67 из 5)