Учебная работа № 1719. Исследование э.д.с. электрохимических ячеек C|Ag|AgI|C и С|Cu|CuBr|C
Альмухаметов Р.Ф. , Якшибаев Р.А., Габитов Э.В., Абдуллин А.Р., Кутушева Р.М.
Иодид серебра AgI и бромид меди CuBr являются униполярными катионными проводниками. Иодид серебра имеет две модификации: до 147оС стабильна bфаза со структурой вюрцита, выше до температуры плавления 555оС aфаза с о.ц.к. структурой. В о.ц.к. элементарной ячейке a AgI , образованой анионами йода, имеются 12 тетраэдрических (d), 6октаэдрических (b) позиций и 24 позиций с тройной координацией (h). Согласно результатам последних исследований катионы Ag+ занимают преимущественно dпозиции, а b и hпозиции заселены слабо [15]. a AgI является быстрым катионным проводником. Элементарная ячейка AgI со структурой вюрцита содержит 2 октаэдрических и 3 тетраэдрических позиций, образованных анионами йода. 2 катиона серебра занимают тетраэдрические позиции. b AgI не является быстрым катионным проводником. CuBr имеет три модификации: до 385оС стабильна gфаза со структурой цинковой обманки, от 385 до 469оС bфаза со структурой вюрцита, выше до расплавления aфаза с о.ц.к. структурой [69]. Все фазы CuBr являются Cu+ катионными проводниками. Структура gCuBr состоит из двух г.ц.к. решеток, сдвинутых друг относительно друга на 1/4 по пространственной диагонали, каждая из которых образована ионами Cu+ и Br соответственно. В г.ц.к. решетке, образованной анионами Br, на элементарную ячейку приходится 8тетраэдрических и 4октаэдрических позиций, которые могут быть заняты катионами меди. Структура a и bфаз CuBr аналогична структуре соответствующих фаз AgI. Детальные исследования распределения катионов Cu+ по различным кристаллографическим позициям в литературе отсутствуют. В данной работе мы сообщаем результаты исследований э.д.с. электрохимических ячеек, содержащих указанные электролиты, и их интерпретацию. Методика эксперимента Для исследований использовали бромид меди марки «ч.д.а». Иодид серебра синтезировали по методике, описанной в раб. [10]. Образцы имели форму таблеток диаметром 5 мм и толщиной около 3 мм, полученных прессованием под давлением 500 мПа. Температуру измеряли с помощью термопары хромельалюмель с точностью *1 К Все исследования проводили в атмосфере осушенного и очищенного азота. Э.д.с ячейки измеряли с помощью цифрового вольтметра В721 с входным сопротивлением не менее 1 ГОм. Результаты исследований и их обсуждение Исследование э.д.с. ячейки С|Ag|AgI|C
Э.д.с. электрохимической ячейки С|Ag|AgI|С (1) описывается известным соотношением [11]: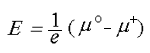 (2) где е заряд электрона; mо, m+ химический потенциал атомов серебра в металле и ионов серебра Ag+ в AgI; C электрод с униполярной электронной проводимостью (графит). Подставляя вместо m+ соответствующее выражение, э.д.с. ячейки (1) можно представить в виде:
(2) где е заряд электрона; mо, m+ химический потенциал атомов серебра в металле и ионов серебра Ag+ в AgI; C электрод с униполярной электронной проводимостью (графит). Подставляя вместо m+ соответствующее выражение, э.д.с. ячейки (1) можно представить в виде: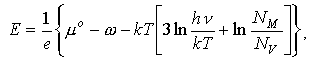 (3)
(3)
где a параметр, равный работе, совершаемой при переносе иона серебра из вакуума в кристалл; k постоянная Больцмана, h постоянная Планка; Tтемпература; nчастота осцилляций ионов серебра; NM и NV число мест в элементарной ячейке, занятых катионами серебра, и число вакантных мест. Учитывая, что![]() , и предполагая слабую температурную зависимость параметра v для угла наклона кривой Е(Т) имеем:
, и предполагая слабую температурную зависимость параметра v для угла наклона кривой Е(Т) имеем: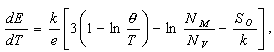 (4) где
(4) где![]() температура Дебая, S0 энтропия атомов меди в металле.
температура Дебая, S0 энтропия атомов меди в металле.
На рис.1 приведены полученные нами экспериментальные кривые зависимости э.д.с. ячейки (1) от температуры. Кривые сняты при нагреве и охлаждении ячейки со скоростью порядка 3 К/мин с выдержкой при 450 °С в течение 2 часов. Из рис.1 видно, что температурная зависимость э.д.с. ячейки носит сложный характер. При Т~140°С на кривой Е(Т) наблюдается максимум. Данная температура близка к температуре ba фазового перехода. Поэтому, данную аномалию мы связываем с переходом AgI из структуры вюрцита в о.ц.к. структуру.
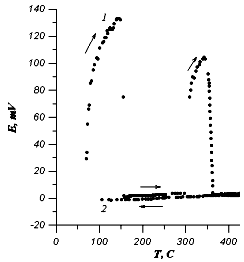
Рис.1. Зависимость э.д.с. электрохимической ячейки С|Ag|AgI|C от температуры.
1нагрев, 2охлаждение.
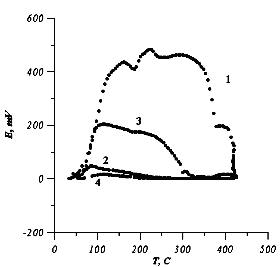
Рис.2. Зависимость э.д.с. электрохимической ячейки С|Cu|CuBr|C от температуры:
1 нагрев, 2 охлаждение, 3 повторный нагрев, 4 охлаждение.
В интервале 150 280 °С э.д.с. ячейки принимает низкие значения и линейно растет с повышением температуры. В интервале 290360 °С наблюдается вторая аномалия на кривой Е(Т). По литературным данным в этом интервале AgI не имеет фазовых переходов. Поэтому мы полагаем, что наблюдаемая аномалия может быть связана с дальнейшим разупорядочением катионной подрешетки и заполнением 6bпозиций. Данный вопрос требует проведения более детальных структурных исследований. С целью выяснения влияния дефектной структуры на э.д.с., а также для достижения равновесия мы провели отжиг ячейки при температуре 460°С в течение 2х часов. Из рис.1 видно, что в результате отжига э.д.с. ячейки незначительно уменьшилась. Это указывает на то, что изменение дефектной структуры при отжиге мало влияет на э.д.с. ячейки. Кривая Е(Т), снятая при охлаждении ячейки (кривая 2), носит линейный характер. На этой кривой аномалии практически отсутствуют. Это указывает на то, что в образцах сохраняется структура с разупорядоченной катионной подрешеткой. После выдержки ячейки при комнатной температуре в течение 24 часов значение э.д.с. несколько повышается. Это свидетельствует о частичном упорядочении катионов серебра по dпозициям. При повторном нагреве аномалии носят более слабый характер. Для отожженных образцов температурный коэффициент Е(Т) имеет положительный знак, что указывает на выделение тепла при разупорядочении Agподрешетки.
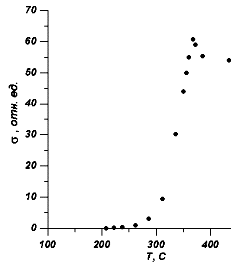
Рис.3 Зависимость проводимости от температуры на частоте 1 мГц.
Из выражения (4) мы рассчитали количество позиций на элементарную ячейку, занятых катионами серебра, используя экспериментальное значение тангенса угла наклона Е(Т) для отожженных образцов. Значения So взяты из [12], параметр Дебая q рассчитали с использованием данных по теплоемкости [13]. При расчетах предполагали, что в интервале 150 460 оС оба катиона серебра являются подвижными. Удовлетворительное согласие расчетных и экспериментальных данных получили при условии, , что 2 катиона серебра занимают не все 12dпозиций, а только примерно 5 из них. Исследование э.д.с. электрохимической ячейки C|Cu|CuBr|C На рис.2 приведены полученные нами экспериментальные значения э.д.с. ячейки C|Cu|CuBr|C (5) в зависимости от температуры.
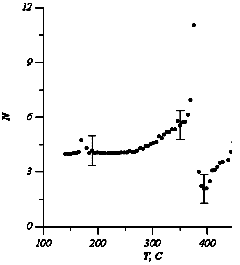
Рис.4. Зависимость количества позиций, занимаемых катионами меди, от температуры.
В интервале температур от 160°С до 250°С кривая Е(Т) проявляет аномальный ход. По литературным данным в CuBr в этом интервале структурные превращения отсутствуют. Поэтому, данную аномалию мы связываем с разупорядочением катионов меди по тетраэдрическим позициям и переходом соединения CuBr в суперионную фазу. Для подтверждения этого мы провели исследование температурной зависимости проводимости CuBr на переменном токе (рис.3). При T?200°С катионная проводимость незначительна. Появление заметной проводимости при температурах T?200°С хорошо коррелирует с аномалией на кривой Е(Т) и служит подтверждением разупорядочения Cuподрешетки.При температурах 360ч380°С э.д.с. ячейки интенсивно падает (рис.3). Температура спада э.д.с. близка к температуре g b фазового перехода. Поэтому мы полагаем, что данный спад э.д.с. связан с переходом CuBr из структуры цинковой обманки в структуру вюрцита. На температурной зависимости проводимости в этом интервале наблюдается аномалия. Заметное уменьшение проводимости при T?380°С объясняется уменьшением числа доступных позиций в расчете на один катион меди при переходе из структуры цинковой обманки в структуру вюрцита. Число доступных позиций на один катион меди для gфазы в предположении, что все катионы меди распределяются по 12dпозициям, равно![]() соответственно при распределении катионов меди меди по 3d и 3d+2bпозициям. Отношение
соответственно при распределении катионов меди меди по 3d и 3d+2bпозициям. Отношение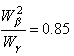 ближе к отношению проводимостей b и gфаз. Это указывает на распределение катионов меди, как по тетраэдрическим, так и по октаэдрическим позициям структуры вюрцита. Уменьшение э.д.с. ячейки при этом переходе можно объяснить уменьшением конфигурационного члена
ближе к отношению проводимостей b и gфаз. Это указывает на распределение катионов меди, как по тетраэдрическим, так и по октаэдрическим позициям структуры вюрцита. Уменьшение э.д.с. ячейки при этом переходе можно объяснить уменьшением конфигурационного члена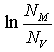 в выражении (3) (NM=4, NV=8 для gфазы и Nm=2, Nn=3 для bфазы). Отжиг ячейки в течение 4х часов при температуре 430°С приводит к уменьшению э.д.с. ячейки до нескольких милливольт. Это объясняется разупорядочением катионов меди по тетраэдрическим и октаэдрическим позициям вюрцитной структуры. На кривых E(T), снятых при охлаждении ячейки, аномалии практически отсутствуют (кривая 2). Это свидетельствует о сохранении разупорядоченной структуры в катионной подрешетке. При повторном нагреве через 24 часа э.д.с. ячейки несколько возрастает (кривая 3), особенности на кривой E(T) сглаживаются. Это указывает на частичное упорядочение катионов меди. Кривые E(T) для отожженных образцов gCuBr имеют отрицательный температурный коэффициент, что указывает на поглощение тепла при разупорядочении Cu подрешетки. Используя экспериментальные значения тангенса угла наклона кривых E(T) мы рассчитали число позиций на элементарную ячейку, по которым распределяются катионы меди. При этом предполагали, что все 4 катиона для г.ц.к. модификации и 2 катиона для вюрцитной модификации являются подвижными. Результаты расчета приведены графически на рис.4. Видно, что при температурах Т?250°С количество позиций, занимаемых катионами меди, близко к 4 и практически не меняется с изменением температуры. Это свидетельствует о том, что катионы меди являются неподвижными. В интервале от ~250 °С до ~360°С количество занимаемых катионами меди позиций увеличивается с 4 до 11, что может быть объяснено разупорядочением катионов по 8d и 4bпозициям г.ц.к. структуры. Эти данные хорошо согласуются с ростом проводимости в интервале 200ч360 °С. При температурах Т?380°С число доступных позиций растет с ~3 до ~5. Это указывает на то, что катионымеди распределяются по 3d и 2bпозициям вюрцитной структуры.
в выражении (3) (NM=4, NV=8 для gфазы и Nm=2, Nn=3 для bфазы). Отжиг ячейки в течение 4х часов при температуре 430°С приводит к уменьшению э.д.с. ячейки до нескольких милливольт. Это объясняется разупорядочением катионов меди по тетраэдрическим и октаэдрическим позициям вюрцитной структуры. На кривых E(T), снятых при охлаждении ячейки, аномалии практически отсутствуют (кривая 2). Это свидетельствует о сохранении разупорядоченной структуры в катионной подрешетке. При повторном нагреве через 24 часа э.д.с. ячейки несколько возрастает (кривая 3), особенности на кривой E(T) сглаживаются. Это указывает на частичное упорядочение катионов меди. Кривые E(T) для отожженных образцов gCuBr имеют отрицательный температурный коэффициент, что указывает на поглощение тепла при разупорядочении Cu подрешетки. Используя экспериментальные значения тангенса угла наклона кривых E(T) мы рассчитали число позиций на элементарную ячейку, по которым распределяются катионы меди. При этом предполагали, что все 4 катиона для г.ц.к. модификации и 2 катиона для вюрцитной модификации являются подвижными. Результаты расчета приведены графически на рис.4. Видно, что при температурах Т?250°С количество позиций, занимаемых катионами меди, близко к 4 и практически не меняется с изменением температуры. Это свидетельствует о том, что катионы меди являются неподвижными. В интервале от ~250 °С до ~360°С количество занимаемых катионами меди позиций увеличивается с 4 до 11, что может быть объяснено разупорядочением катионов по 8d и 4bпозициям г.ц.к. структуры. Эти данные хорошо согласуются с ростом проводимости в интервале 200ч360 °С. При температурах Т?380°С число доступных позиций растет с ~3 до ~5. Это указывает на то, что катионымеди распределяются по 3d и 2bпозициям вюрцитной структуры.
Заключение
В результате проведенных исследований нами показано, что температурные зависимости э.д.с. электрохимических ячеек, содержащих твердые электролиты AgI и CuBr, носят сложный характер. На кривых E(T) обнаружены особенности, связанные как с переходами AgI и CuBr из одной модификации в другую, так и соответствующие разупорядочению катионной подрешетки и переходу соединений в суперионную фазу. Показано, что формулы (3) и (4) могут быть использованы для качественного и количественного описания э.д.с. ячеек, содержащих твердые электролиты AgI и CuBr.
Список литературы
1. Kusakabe M., Ito Y., Arai M. et all // Sol. State Ionics. 1996. v.8688, p.231234.
2. Hashino S., Sakuma T., Fujishita H. et all // J. Phys. Soc. of Japan. 1983. v.52. №4. p.12611269.
3. Suzuki M., Okazaki H. // Phys. Stat. Sol.(a), 1977. v.42. p.11440.
4. Hashino S., Sakuma T., Fujii Y. // Sol. State Comm. 1977 v.22. p.763765.
5. Cava R.J., Fleming R.M., Rietman E.A. // Sol. State Ionics. 1983. v.910. p.13471352.
6. Schulz H.// Ann. Rev. Mater. Sci., 1982. v.12. p.351376.
7. Bazan J.C., Pettigrosso R.S., Garciaet N.J. all //Sol. State Ionics, 1996 v.8688. p.241245.
8. Boyce I., Hayes T. // Sol. Stat. Comm. 1980. v.35. p.237241.
9. Schulz H. // Ann. Chim. (France). 1982. v.7. p.161170.
10. Руководство по неорганическому синтезу / Под ред. Брауэр Т. М.: Мир, 1985. с.
11. Чеботин В.Н.. Физическая химия твердого тела. I.: Oeiey, 1982. 320 n.
12. Свойства элементов / Под ред. Самсонова Г.В. М.:Металлургия, 1976.600 с.
13. Физические величины. Справочник / Под ред. Григорьева И.С., Мейлихова Е.З. М.: Энергоиздат, 1991.1232 с.

 (6 оценок, среднее: 4,67 из 5)
(6 оценок, среднее: 4,67 из 5)